
П.В. Папырин, А.В. Сухов, Д.А. Ягодников
2
Инженерный журнал: наука и инновации
# 6·2017
скорости изменения массы реагентов и тепловыделения в результате
протекающих химических реакций. В случае использования порош-
кообразного металлического горючего, в частности бора или его
соединений с алюминием, для моделирования источниковых членов
возможно применение эмпирических зависимостей, определяющих
массовые скорости горения и тепловыделения, или реализация в ма-
тематической модели алгоритма расчета характеристик воспламене-
ния и горения одиночных частиц металлического горючего, который
основан на макрокинетических физико-химических процессах взаи-
модействия горючего и окислителя.
Описание математической модели.
Рассмотрим описание матема-
тической модели воспламенения и горения в воздухе одиночной части-
цы горючего, в качестве которого выбран диборид алюминия АlB
2
.
Перспектива использования его определяется высокими значениями
плотности (
к
~ 3000 кг/м
3
) и теплоты сгорания (∆
Н
AlB 2
~ 46,1 МДж/кг).
В модели воспламенения сферической частицы диборида алюми-
ния в воздухе на основе теории параллельных химических реакций
[4, 5] приняты следующие допущения.
1. Частица диборида алюминия представляет собой равномерно
перемешанный сплав бора и алюминия, причем доля поверхности, за-
нимаемая каждым из элементов, пропорциональна их мольной доле в
сплаве.
2. Параллельные химические реакции окисления алюминия и бо-
ра протекают на соответствующих поверхностях частицы, пропорци-
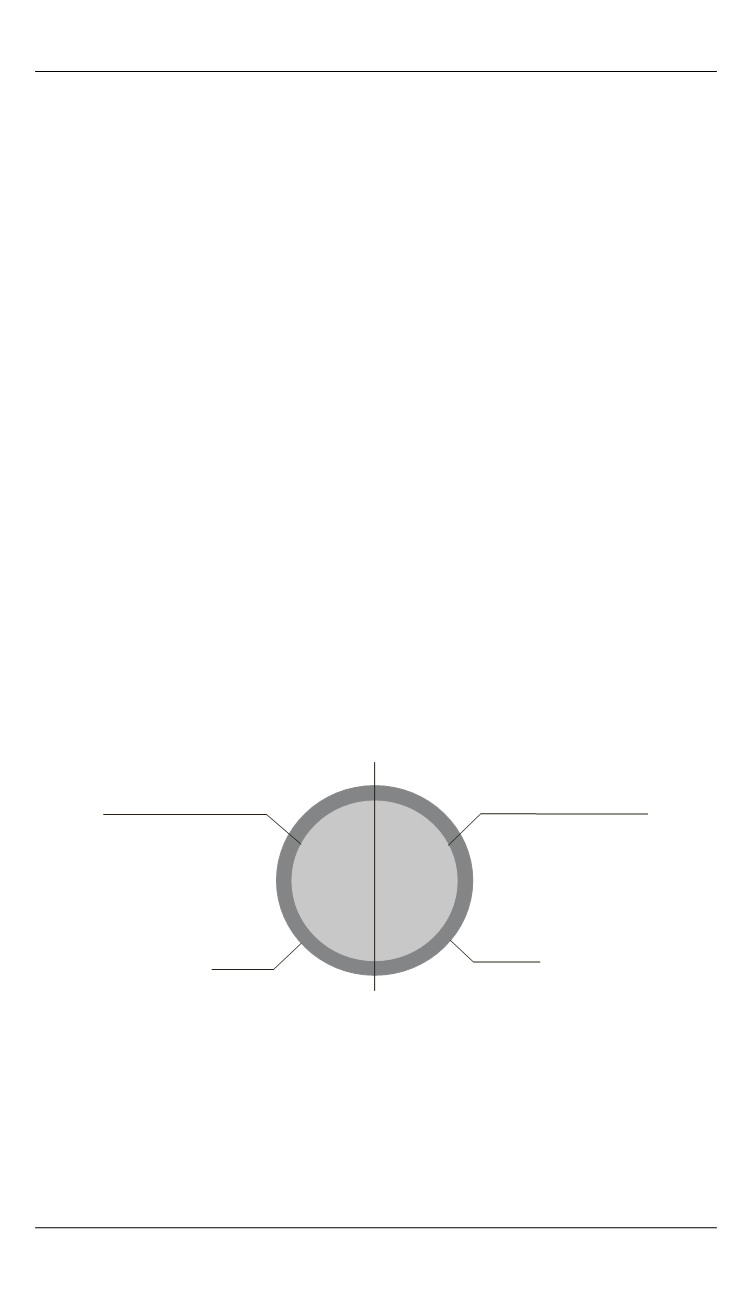
ональных мольной доле в сплаве (рис. 1).
Рис. 1.
Схема модели воспламенения частицы диборида алюминия
3. Оксидные пленки оксида алюминия и оксида бора покрывают
всю поверхность частицы.
4. Все физико-химические процессы при горении происходят в
пределах центрально-симметричной приведенной пленки, радиус ко-
торой определяется условием теплообмена с окружающей газовой
средой.
Al + 3/4О
2
⇒
1/2Al
2
O
3
Al
2
O
3
B + 3/4О
2
⇒
1/2B
2
O
3
B
2
O
3
Аl
B
















